2015年底GMP检查下放到省局后,国家局专心进行飞行检查,我们对2016年度CFDA通报的飞行检查情况进行汇总,数据来源为CFDA网站“飞行检查”专题中的“药品”部分,内容包括飞行检查和跟踪检查,截止到6月7日(以通报时间为准),2016年上半年,CFDA共通报飞行检查(跟踪检查)15次,包括不符合项54项,综合分析,今年的飞行检查有以下特点:
1、检查方式的变化。
在15次通报中,包括飞行检验8次,跟踪检查7次,两者比例相差不大,这是一个新的信号。

飞行检查是一种有因检查,往往是在发生重大药品事件、收到举报信息等情况时才进行,多数针对的是特定、高风险产品,比如:无菌制剂、提取物、中药饮片等,检查内容也有很强的目地性,仅对某一产品或事项进行专项检查,所以飞行检查在覆盖范围上有一定的局限性。而跟踪检查是一种常规检查,不受检查时间、生产品种、企业类型的限制,能达到全部药品生产企业全覆盖,检查的涉及范围更广,包括GMP相关的全部内容。
往年的通报多数都是针对飞行检查的,企业对飞行检查也是“闻飞色变”,飞检虽然可怕,但数量小,对于国内药业巨大的分母数量,概率还是很小的,很多企业还是有一种赌一把的心理。跟踪检查虽然普遍,却很少听说因为跟踪检查发通报、收证的情况,今天上半年就有7家被通报,这与以前相比都是很高的数量,甚至有两家企业是跟踪检查后因整改不合格而通报的,相信今后会有更多的跟踪检查通报,各企业也不要再有任何侥幸心理,踏踏实实做好GMP工作,迎接飞检日常化的“新常态”。
2、处罚结果更严厉。
在15家企业的处理措施当中,有14家收回GMP证书(或不换发GMP证书),占比93%,同时也包括停产调查、召回产品等要求。
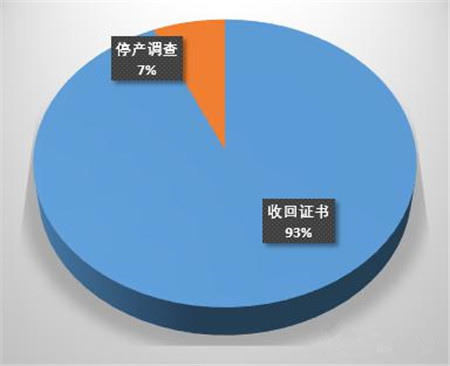
从今年起,收证已成为首选项,整改、停产、召回等作为附加的处罚措施。2015年全国一共收回140张GMP证书(来源:CFDA网站),其中大部分是飞检和专项检查的原因,按目前飞检的力度,CFDA对违规零容忍的程度,2016年又会有多少张GMP证书被收回?如果不想被收证,就必须要做到日常管理零缺陷。
3、不符合项数量虽少,内容更集中。
全部15次检查一共有54个不符合项,平均仅为3.6项,不符合项数量的减少,并不意味着检查尺度的放宽。
虽然从数量上来看,不符合项并不算太多,大多数企业仅有2-3条,但仔细分析,可以发现条条都是要害,显然检查的针对性更强,不符合项集中分布在几大方面,包括真实性、合规性、溯源性等,这些内容将成为今后各项检查的要点,也是我们完善GMP工作的重点。
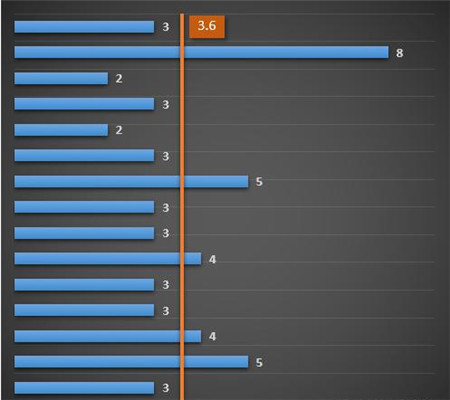
我们将全部54项不符合项分成以下几个方面:资质合规、记录规范、原料来源(供应商审计)、库房管理,数据可靠性、工艺符合性、质量管理(偏差、质量回顾、验证等)、其它,每个项目具体的不符合项数量如下:
|
资质合规
|
4
|
|
记录规范
|
5
|
|
原料来源
|
11
|
|
库房管理
|
5
|
|
数据可靠性
|
11
|
|
工艺符合性
|
9
|
|
质量管理
|
6
|
|
其它
|
3
|
|
合计
|
54
|
从中可以看出,原料来源、数据可靠性和工艺符合性所点比例最大,超过了50%,后面会重点分析。
4、原料来源是飞行检查的重中之重。
原料来源出现的比例很高,15家企业中有11家出现,达到73%,原料来源已成为比较普遍的问题。
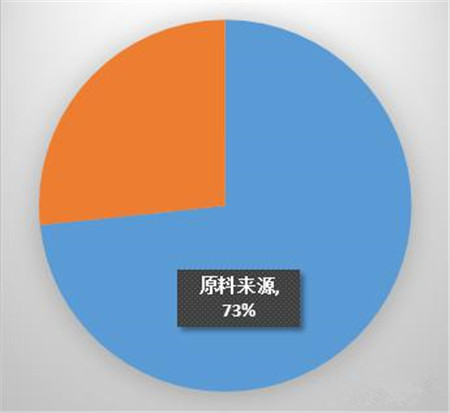
原料来源的问题主要包括两方面:供应商审计、原料使用。有的企业没有对供应商进行审计,或者虽然有审计,但内容比较简单,仅有资质的审核,或没有达到审计的效果,不能达到保证产品质量的作用。尤其是对关键原料供应商的上游的审计成为盲点,比如供应商的原料来源追溯不清,因为供应商的上家往往并不是药品生产企业,因此在质量管理水平上会有很大的差距,也有故意违规的现象,这方面动物源的原料出现的问题更多。对供应商审计要达到什么样的程度和深度,这些都成为新的课题。
另一个主要问题是原料使用中的缺斤短两、偷工减料,这个在中药提取方面问题比较严重,没有按批准的工艺进行提取,或者以中药材代替中药饮片,或者以中药提取物量投料生产,擅自添加提取成份等现象都有出现,更不要提以次充好、以假药材冒充的情况了。
5、真实性问题成为重灾区
从2015年起,真实性问题成为各项检查关注的重点,这次通报的15家企业,几乎都包括真实性问题。

我们可以从生产、检验两个方面把真实性问题简单的分成工艺合规和数据可靠性两类。
工艺合规是指要按照批准的工艺进行生产,一种是改变工艺处方,这其实涉及到大量的历史问题,有些产品当年注册时为了抢速度,处方工艺并不成熟,批准后企业又不愿意按正常的流程更改处方,目前进行的一致性评价工作也是重点解决仿制水平低、生产工艺混乱的问题。另一种是改变生产工艺,擅自增加、减少或改变工艺流程,比如去年影响很大的银杏叶事件,主要的目地是为控制生产成本,附带着就会出现相应的编制记录、台账的情况,这些都是十分严重的问题。
数据可靠性是大热门了,相信经过去年一年的洗礼,各家企业都会把数据可靠作为工作的重点,其实数据可靠性涉及的范围很广,包括GMP实行的方方面面,这里我们仅仅取其狭义的检验数据可靠,主要集中在套用图谱、修改时间、不规范进样、删除数据等方面,要解决数据可靠性的问题,最重要还是人员意识的提高,并不简单的升级网络版工作站就能达到的。要踏踏实实的做好基础工作,比如账户分级、权限设置,操作人员的培训考核,制度的完善,计算机化系统验证,生产工艺的稳定,没有这些基础工作,数据可靠性只能是纸上谈兵。