自2015年下半年起,我国医疗器械行业在政策的利好和支持下正在蓬勃发展。2016年初,国家药监局召开了全国医疗器械监督管理工作会议。其中政府又作出了利好医械的决策。
推进医疗器械审评审批体系建设

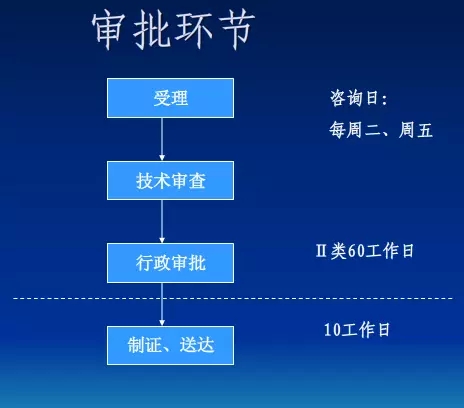
这张图为常规的医械审批流程。其中行政审批再加上制证、送达的时间一共为70个工作日。这是十分花费时间的。而在1月21日召开的全国医疗器械监督管理工作会议上,国家药监总局明确表态,将着力推进医疗器械审评审批体系建设,建立起更加科学、高效的医疗器械审评审批体系,使技术审评能力适应我国医疗器械创新研发和产业发展的需要。这是国家政府利好医械的表现。
中国医疗器械预测:日后“行政审批再加上制证、送达的时间”这段时间获奖减少。让械企花更多的时间在市场布局上。
能否简化审批流程,成为业界关注的焦点。会议上,国家药监总局表示将研究对列入国家重点研发计划、重大科技专项和临床急需的医疗器械产品加快审评审批政策措施,加强产业创新扶持,促进医疗器械产业健康发展。
创新医械已受益
2014年2月7日,CFDA发布了《创新医疗器械特别审批程序(试行)》,并于同年3月1日生效。该程序是在确保上市产品安全、有效的前提下,针对创新医疗器械设置的审批通道。
其中第二十条,二十一条规定:
食品药品监管总局受理创新医疗器械注册申请后,应当将该注册申请项目标记为“创新医疗器械”,并及时进行注册申报资料流转。
已受理注册申报的创新医疗器械,食品药品监管总局医疗器械技术审评中心应当优先进行技术审评;技术审评结束后,食品药品监管总局优先进行行政审批。
截至2015年底,国家总局共收到创新医疗器械特别审批申请295项,完成审查249项,审查确定了脑起搏器等44个产品进入创新医疗器械特别审批通道,药物洗脱外周球囊扩张导管等19个产品已进入审评环节,已批准注册脱细胞角膜基质等10个产品上市。
据悉,创新产品特别审批的时间可以短至2到4个月,时间比一般审批快了很多,这样就可以先人一步布局市场,拿到优势。创新类产品将更容易获批,特别是三类中优秀的创新医疗器械,进入特别审批程序后,借着国产化趋势,有望一路伴随好契机。
在不久的将来,那些拥有一技之长的小微企业及个体,有了更多的逆袭机会,今后医疗器械技术市场,只要拥有技术专利就能与大公司合作,源源不断地转卖给他们生产销售。